ISO 13485 Software für das Qualitätswesen in der Medizintechnik
Im Vordergrund der ISO 13485 Rahmenbedingungen für die Herstellung medizintechnischer Produkte stehen unter anderem die Anwendung von CAPA-Maßnahmen (Corrective and Preventive Actions), die durchgängige Gewährleistung von Traceability und die Änderungsverfolgung (Change Control), die Umsetzung eines normenkonformen Risikomanagements sowie der konsequente Einsatz eines Schulungs- und Dokumentenmanagements. Um diese zahlreichen Anforderungen einhalten zu können, benötigt man ein Managementsystem, das eine lückenlose Dokumentation und flächendeckende Überwachung gewährleistet sowie rasche, bereichsübergreifende Reaktionen auf Veränderungen jedweder Art ermöglicht: Dieses System ist CAQ.Net.
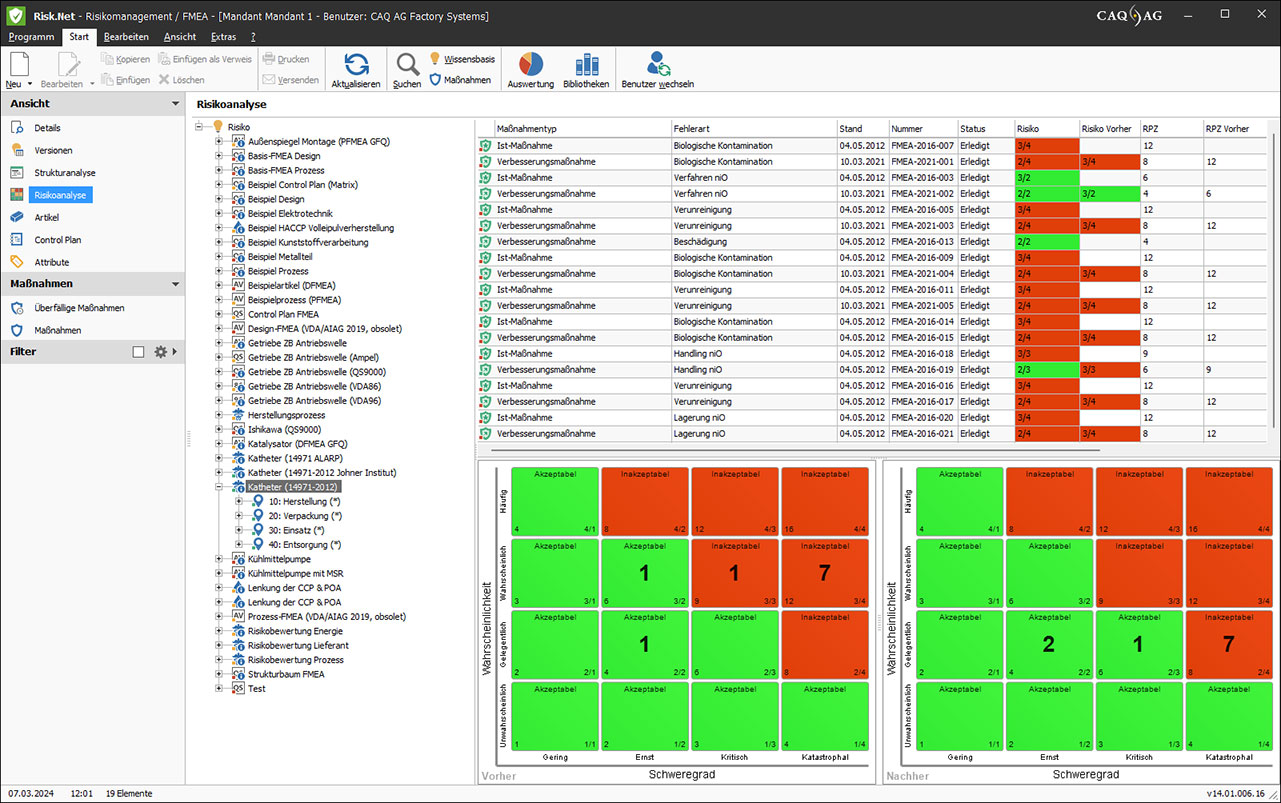 Vorher-/Nachher-Risikomatrix nach DIN EN ISO 14971
Vorher-/Nachher-Risikomatrix nach DIN EN ISO 14971
Normanforderungen erfüllen mittels Software
CAQ.Net ist eine vollständig validierbare, modular aufgebaute Softwarelösung, die die konsequente Einhaltung interner und externer Anforderungen sowie behördlicher und gesetzlicher Auflagen erlaubt. Ob es um die Umsetzung medizintechnisch relevanter Anforderungen laut MDR, GxP, FDA oder ICH oder die Einhaltung entsprechender Normen und Richtlinien wie beispielsweise ISO 13485, 21 CFR 820, DIN EN ISO 14971 oder 21 CFR Part 11 geht: Mit CAQ.Net wird ein flächendeckendes Compliance Management geschaffen, das die Einhaltung interner sowie gesetzlicher Vorgaben in einer wohlstrukturierten und einfach nutzbaren Arbeitsumgebung sicherstellt.
Meistgenutzte Komponenten der ISO 13485 Software
CAPA
Leiten Sie CAPA-Prozesse mit verschiedensten Auslösern, etwa aus dem Prüfmittelmanagement, dem Auditmanagement oder der Reklamationsbearbeitung, mittels der assistentengestützten Funktion in CAQ.Net ein.
Erfahren Sie mehr zum
CAPA-Assistent »
Risikomanagement
Erkennen, bewerten und dokumentieren Sie relevante Risiken und erfüllen Sie die Vorgaben der DIN EN ISO 14971.
Erfahren Sie mehr zur
Risikomanagement-Software »
Root Cause Analysis
Erforschen Sie die Ursachen von Problemen und decken Sie Verbesserungspotenziale mittels Ishikawa-Diagrammen und der 5-Why-Methode auf.
Erfahren Sie mehr zur
RCA-Software »
Dokumentenlenkung
Mit QBD.Net stehen jedem Mitarbeiter die für ihn notwendigen Dokumente in der aktuellen Version zum richtigen Zeitpunkt zur Verfügung. Sie können jederzeit die relevanten Lenkungsschritte einsehen und belegen.
Erfahren Sie mehr zur
Dokumentenlenkung-Software »
Qualifikationsmatrix
Behalten Sie stets die Qualifikationen Ihrer Mitarbeiter im Blick und lassen Sie sich automatisch erinnern, wenn diese erneuert werden müssen.
Erfahren Sie mehr zur
Qualifikationsmatrix-Software »
Change Control
Überwachen und steuern Sie sämtliche Veränderungsprozesse im Unternehmen flächendeckend und zentral und behalten so stets alle Details im Blick.
Erfahren Sie mehr zur
Änderungsmanagement-Software »
Datenvalidierung
Dokumentieren Sie alle Datenänderungen in Ihrem CAQ-System und verfolgen diese lückenlos zurück.
Erfahren Sie mehr zur
Audit-Trail-Funktion in CAQ.Net »
Medizintechnik-Unternehmen, die auf CAQ.Net vertrauen